Anh khẳng định quá trình phê duyệt vắc-xin của Pfizer/BioNTech không bị rút ngắn
Ngày 4/12, Cơ quan quản lý dược phẩm và các sản phấm y tế của Anh (MHRA) khẳng định việc phê duyệt lưu hành vắc-xin ngừa COVID-19 của Pfizer/BioNTech đáp ứng đầy đủ các tiêu chuẩn về an toàn.

Trong tuyên bố, MHRA nhấn mạnh bất kỳ vắc-xin nào cũng phải trải qua các cuộc thử nghiệm lâm sàng gắt gao theo đúng chuẩn quốc tế, dưới sự giám sát của cơ quan này. Do đó, sẽ không vắc-xin nào được phép phân phối tại Anh trừ phi chúng đáp ứng tiêu chuẩn về an toàn, chất lượng và hiệu quả.
Nguyên nhân giúp MHRA thể phê duyệt nhanh như vậy là bởi cơ quan này đánh giá dữ liệu do Pfizer và BioNTech cung cấp trong quá trình vắc-xin được thử nghiệm trên người, thay vì đợi tổng hợp toàn bộ dữ liệu lúc thử nghiệm kết thúc.
MHRA nêu rõ các vắc-xin COVID-19 đang được hợp tác bào chế, qua đó cho phép một số bước có được tiến hành song song nhằm rút ngắn thời gian. Tuy nhiên, điều này không đồng nghĩa với việc các tiêu chuẩn an toàn, chất lượng và hiệu quả đã bị xem nhẹ.
Giám đốc MHRA June Raine cũng từng khẳng định không hề “rút bớt” công đoạn trong việc phê duyệt vắc-xin của Pfizer/BioNTech.
Trước đó, Anh đã trở quốc gia phương Tây đầu tiên trên thế giới phê duyệt lưu hành vắc-xin ngừa COVID-19, khi MHRA cấp phép sử dụng vắc-xin do hãng Pfizer của Mỹ và hãng BioNTech của Đức đồng phát triển. Anh dự kiến sẽ phân phối lô vắc-xin đầu tiên gồm 800.000 liều vào tuần tới, trong đó ưu tiên các nhà dưỡng lão.

*Cùng ngày, Công ty công nghệ sinh học Clover Biopharmaceuticals của Trung Quốc thông báo hai vắc-xin ngừa COVID-19 do hãng này sản xuất đã kích hoạt được phản ứng miễn dịch mạnh và cho thấy độ an toàn trong giai đoạn đầu thử nghiệm trên người.
Clover nêu rõ vắc-xin chứa tá dược của GlaxoSmithKline (GSK) và vắc-xin chứa tá dược từ Dynavax đều dẫn đến các phản ứng miễn dịch mạnh bao gồm việc các kháng thể trung hòa và miễn dịch tế bào khi thử nghiệm lâm sàng giai đoạn 1. Tá dược là một thành phần được bổ sung vào vắc-xin nhằm tăng cường phản ứng miễn dịch trong cơ thể và giúp vắc-xin hoạt động hiệu quả hơn.

Theo thông báo, dựa trên kết quả thử nghiệm tích cực trong giai đoạn 1 và nhu cầu cấp thiết đối với vắc-xin, Clover và các đối tác đang tự tin bước vào giai đoạn phát triển cuối cùng của 2 loại vắc-xin. Hai vắc-xin này đều không gây ra phản ứng nghiêm trọng nào đối với 150 người trưởng thành và lớn tuổi tham gia thử nghiệm.
Dự kiến vắc-xin sử dụng tác dược của GSK sẽ bắt đầu thử nghiệm giai đoạn tiếp theo và thậm chí là cuối cùng trong tháng này, trong khi vắc-xin dùng tá dược của Dynavax sẽ bắt đầu thử nghiệm giai đoạn 2 trong nửa đầu năm 2021.

Theo kết quả sơ bộ, cả hai vắc-xin đều có thể bảo quản ở nhiệt độ từ 2 – 8 độ C trong ít nhất 6 tháng. Theo Clover, vắc-xin có thể ổn định ở nhiệt độ phòng hay 40 độ C trong ít nhất một tháng. Chi phí thử nghiệm của Clover do Liên minh Đổi mới sáng tạo sẵn sàng cho dịch bệnh (CEPI) tài trợ một phần.
Trong diễn biến khác, nhà nghiên cứu tại Viện Kỹ thuật Trung Quốc và cũng là Phó Trưởng nhóm chuyên gia về phát triển vắc-xin thuộc Quốc vụ viện, ông Vương Quân Chí cho biết vắc-xin đã sẵn sàng để sử dụng trong năm nay và “một tuyên bố quan trọng” sẽ được đưa ra trong vòng 1 – 2 tuần tới. Theo kế hoạch, sẽ có 600 triệu liều vắc-xin sẵn sàng tung ra thị trường trong năm nay.
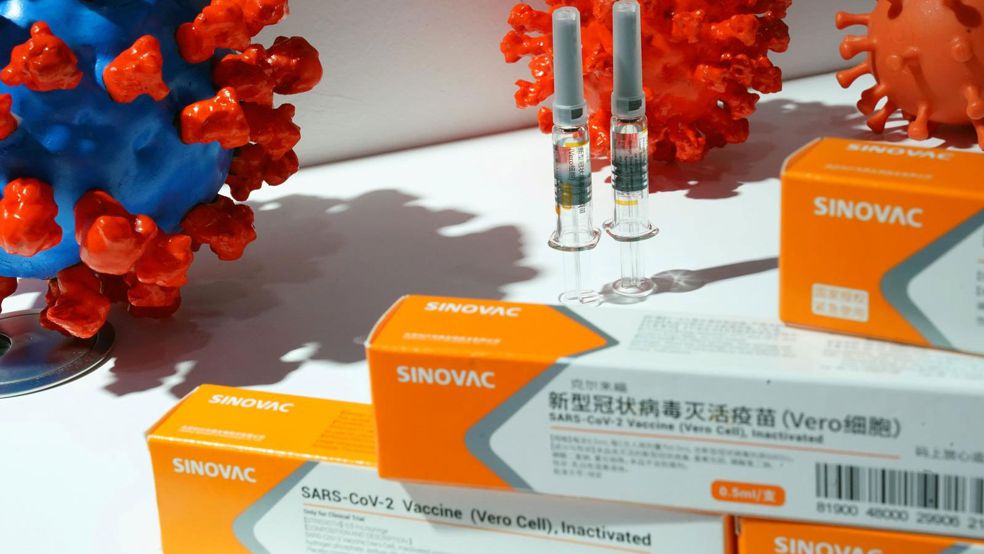
Theo ông Vương Quân Chí, đây là loại vắc-xin được nghiên cứu thông qua việc tiêu diệt virus trong phòng thí nghiệm và sử dụng nó để kích hoạt phản ứng miễn dịch. Trong số này có hai loại vắc-xin bất hoạt do Tập đoàn Biotec Quốc gia Trung Quốc (CNBG) phát triển và loại thứ ba do Sinovac Biotech nghiên cứu đang ở trong giai đoạn thử nghiệm lâm sàng cuối cùng tại Nam Mỹ, Trung Đông và châu Á. Tuy nhiên, các nhà sản xuất dược phẩm vẫn chưa công bố bất kỳ dữ liệu liên quan đến giai đoạn III để được phê duyệt theo quy định. (BTT)